定量PCR比LAMP在病原体检测上更加敏感吗?
自从日本人2000年发明了LAMP技术,LAMP被专利保护了13年,所以一直没有在实验室和临床诊断领域被广泛测试和应用。与此同时,其他的恒温PCR技术譬如RPA等也相继出现,但总的来说,恒温PCR在敏感性、特异性和稳定性方面还没有得到广泛的验证和认同。可以毫不夸张地说,定量PCR作为金标准的霸主地位至今还没有被撼动过。
但是最近这个认知开始有些改变。首先,新冠疫情期间,美国FDA批准了几家应急使用的LAMP检测试剂盒用来检测新冠病毒,尽管后来随着新冠疫情的结束,大部分的试剂盒没有获得FDA的正式批文,LAMP技术作为快捷检测的工具开始逐渐被FDA和业界人士认同。其次,随着酶制剂基因工程改造技术的革新和冻干技术的迅猛发展,LAMP开始被越来越多地应用到临床诊断领域。善本生物独创的 HmPCR™整合了LAMP技术(HmPCR™-LAMP)和传统PCR技术(HmPCR™-PCR)的优点,使临床检测更加快捷、敏感和家庭化。
以HmPCR™-LAMP为基础,善本生物开发了用于非洲猪瘟病毒检测的HmPCR™-16孔快检仪及其配套使用的试剂盒,这个试剂盒可以在30分钟完成“样本进-结果出”的快检效果。自从这个产品投放市场以来,用户一直想知道它的敏感性是否能达到了定量PCR的标准。鉴于这个问题的普遍性,本文想从以下几个方面来探讨这个问题:
1、反应体系的检测极限:基于善本生物的经验数据和全球公认的临床大数据,定量PCR技术能检测到的病毒量极限,又叫检测极限,是10个拷贝的病毒/反应。尽管从理论上说,定量PCR可以检测到1个拷贝的病毒(相当于CT值36左右),但赛默飞等权威公司的数据表明当病毒低于5个拷贝的时候,检测结果就不太可靠了(见图1)。与定量PCR相比,LAMP技术在检测极限上略逊一筹,善本生物通过对自主拥有的LAMP平台进行反复测试后,发现LAMP技术的检测极限稳定在70-80个拷贝/反应,这个拷贝数对应的定量PCR的CT值为34.6左右。
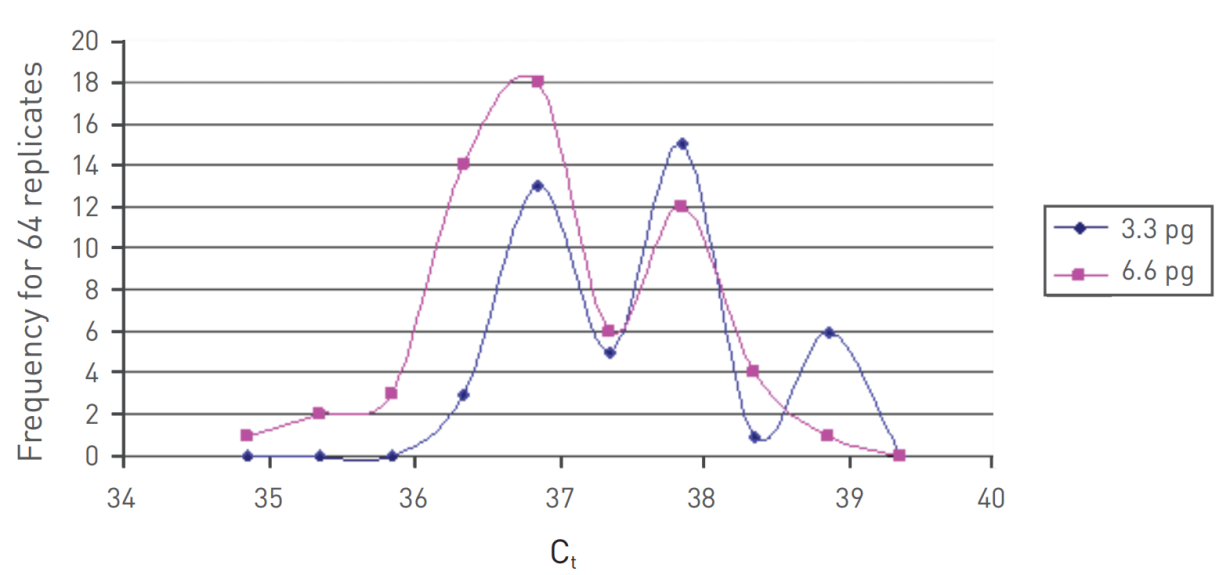
图1、当模版低于5个拷贝时,检测到的CT值不再可靠。途中的蓝线和紫线分别代表DNA拷贝数为1(即3.3 pg)和2(即 6.6 pg),图中的曲线表示64个重复实验的CT值频率分布。也就是说,当DNA模版为1个拷贝的时候,检测大部分CT值几种在在36.8左右,变动范围在34.8-39.2之间。 摘自赛默飞:Real-Time PCR: Understanding CT。
2、检测限的科学定义:上述对检测极限的定义完全是为了方便读者理解,其实这个定义并不完全科学,在临床诊断上经常使用的对应观念是检测限。国际上对检测限(Limit of Detection,LoD)的定义是指在病原体在样本中的原始浓度,按照拷贝/毫升计算,更准确地来说,是指能够被特定试剂盒检测到的最低原始浓度。每一个试剂盒的LoD都不一样,LoD的大小取决于特定试剂盒规定的采样方式以及试验流程的设计。举例来说,如果某个非洲猪瘟试剂盒提纯核酸的使用量为2微升时,检测到的LoD是100拷贝/毫升,按照理论计算,当使用提纯核酸的体积变为5微升时,这个试剂盒的LoD就应该是40拷贝/毫升了。所以,检测限的概念是相对的,但一个经过测试的试剂盒在市场上使用时因它的采样过程和试验流程是固定的,它的LoD也就是唯一的了,所以,可以形象地说,LoD是一个试剂盒的指纹,不同公司开发的试剂盒的LoD都会不一样,单方面谈检测限(LoD)的绝对值是没有意义的。
3、检测敏感度比较的标准:基于上述的讨论,我们会得出这样的结论,那就是虽然检测限的定义随着采样方法和检测流程的不同而改变,检测限仍然可以作为一个有用的指标来比较不同检测技术或试剂盒之间的敏感性。简言之,LoD数值越低,敏感性就越高,反之亦然,这个标准也是全球公认的。但是,如果把反应体系的检测极限(讨论的第一点)作为比较不同技术之间的敏感性,譬如LAMP vs 定量PCR,就会容易被误导,因为技术检测极限是可以通过采样和试验流程的优化来突破的,以至于LAMP技术得到的检测限可以和定量PCR得到的检测限相媲美,甚至前者有可能超过后者。
4、举例说明:下面我们举一个例子,用数据来说明上面论述的观点。1)按照某非洲猪瘟定量PCR检测试剂盒的规定,采样时要先把猪鼻(棉)拭子浸泡在生理盐水里,然后在猪的鼻子里旋转采样。而善本的LAMP试剂盒采样时使用的鼻拭子是干拭子,它的材质是尼龙纤维。这些尼龙纤维的数量可达到成百万个,垂直分布在拭子上,形成均匀分散的中空微腔室。这些微腔室不仅可以有效刮取鼻咽细胞,而且被采的样本很容易完全脱落到稀释液里。就采样这一步,善本的拭子就可以采集到1000倍于对比试剂盒的非瘟病毒样本了。2)假设对比试剂盒能够100%抽提非瘟病毒的核酸(大部分的试剂盒都做不到核酸在抽提过程中不丢失),根据说明书该试剂盒用200微升的洗脱液来洗脱核酸,而在反应时只使用5微升的核酸,这样,病毒被稀释的倍数为5/200= 1:40。根据善本非瘟试剂盒的说明,我们的干拭子采集的病毒从采集到反应被稀释100,即1:100。3)假设猪的鼻腔粘膜含有10^9个病毒,对比试剂盒的湿拭子取了100个病毒,我们的干拭子就可以取10^ 6个病毒。以上的数字乘以稀释倍数,我们可以就可以得出以下结论:对比试剂盒用于定量PCR的病毒检测量为100x 1/40= 2.5个病毒, 10^6 x 1/100 = 10^4。2.5个病毒可能不会被定量PCR试剂盒检测到,而10^4的病毒远远超过LAMP的检测限,很容易被善本的试剂盒检测到。

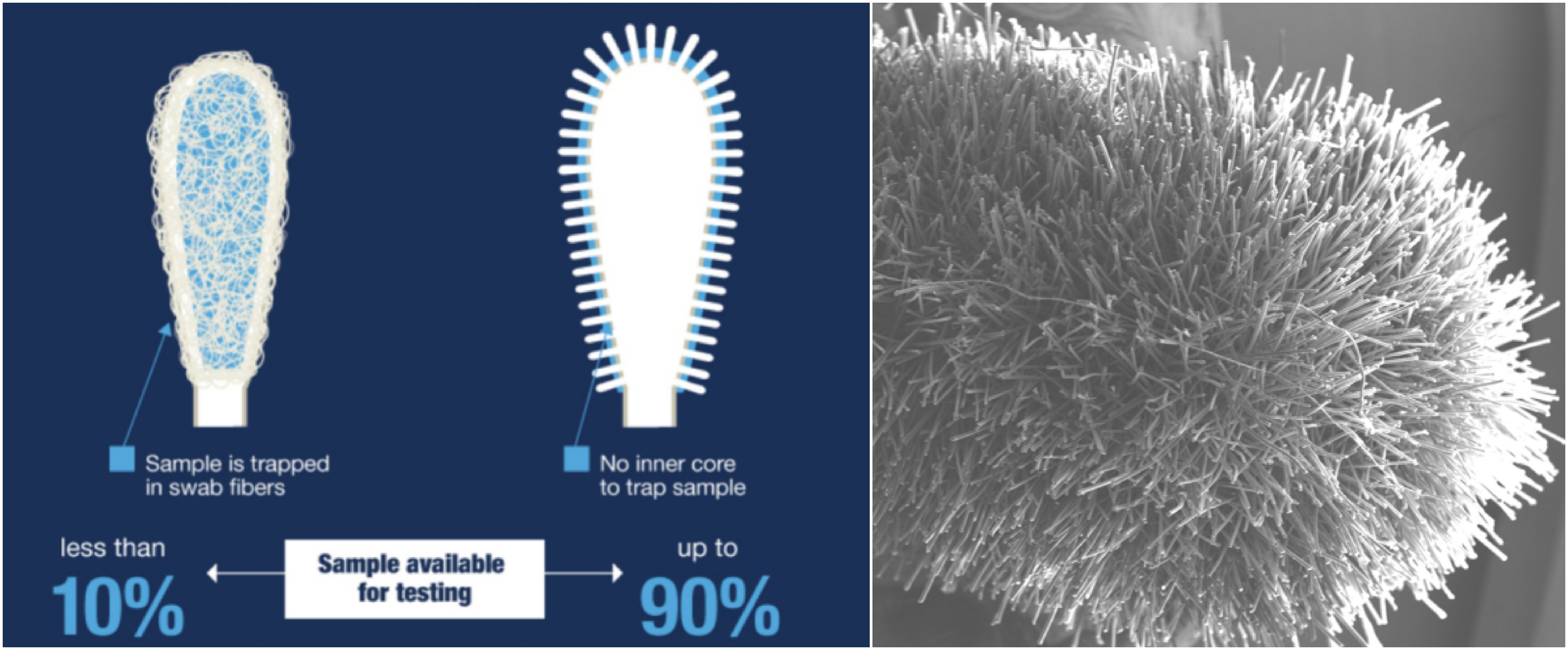
图2、善本生物鼻拭子的独特设计使样本的采样量更多,采样后样本更容易被释放到液体里。左图:传统(左)和善本生物(右)鼻拭子的比较。右图:善本生物鼻拭子的显微结构。
现在让我们回到标题中问到的那个问题:定量PCR比LAMP在病原体检测上更加敏感吗?答案是不一定。在理解了PCR和LAMP技术的检测极限和试剂盒特有的检测限的不同后,我们会清楚地发现LAMP技术在检测极限上的略微劣势可以很好地被采样方法或试验流程的优化来弥补和加强。反之,LAMP技术相对PCR技术的优势也很明显:直接加样本无需核酸抽提、冻干微球无需冷链运输可以室温保存、生化反应不再依赖昂贵仪器、样本进结果出只需30分钟等等。善本的HmPCR™-LAMP平台通过试剂和流程优化有效解决了传统实验室LAMP技术的非特异性和酶制剂的室温保存两大瓶颈问题,开发出的系列产品在敏感性上不逊于定量PCR试剂盒。善本另外一个平台HmPCR™-PCR保留了传统PCR高敏感性高特异性的优点,采取傻瓜式一体机的设计,把核酸自动抽提和PCR反应整合到一台设备中,一个样本可以检测16种病原体,不仅大大提高了检测效率,而且节约了时间和材料成本。这两个平台技术的应用场景略有不同,但其功能可以做到相互弥补,甚至相互替代。简言之,两个平台的开发和使用正好说明了PCR和LAMP技术的互补性和兼容性。
-作者:TIM H. SHI,分子生物学博士


